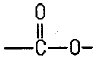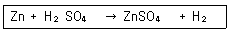화학분석기사(구) 필기 기출문제(해설) 및 CBT 모의고사(2025년 11월 23일)(9659032)
최강 자격증 기출문제 전자문제집 CBT : www.comcbt.com
전자문제집 CBT란?
종이 문제집이 아닌 인터넷으로 문제를 풀고 자동으로 채점하며 모의고사, 오답 노트, 해설까지 제공하는
무료 기출문제 학습 프로그램으로 실제 상설검정에서 사용하는 OMR 형식의 CBT를 제공합니다.
최신 화학분석기사(구) 필기 기출문제 : [다운로드]
| 1과목 : 일반화학 |
정답 : [ 2 ] 정답률 : 86%
|
정답 : [ 2 ] 정답률 : 84%
|
정답 : [ 4 ] 정답률 : 72%
|
정답 : [ 1 ] 정답률 : 91% |
정답 : [ 3 ] 정답률 : 64%
|
정답 : [ 2 ] 정답률 : 82%
|
정답 : [ 3 ] 정답률 : 81%
|
정답 : [ 4 ] 정답률 : 60%
|
정답 : [ 1 ] 정답률 : 87%
|
정답 : [ 2 ] 정답률 : 88% |
정답 : [ 3 ] 정답률 : 88%
|
정답 : [ 3 ] 정답률 : 86%
|
정답 : [ 4 ] 정답률 : 85%
|
정답 : [ 2 ] 정답률 : 83%
|
정답 : [ 4 ] 정답률 : 63% |
정답 : [ 3 ] 정답률 : 81%
|
정답 : [ 4 ] 정답률 : 76% |
정답 : [ 3 ] 정답률 : 89% |
정답 : [ 1 ] 정답률 : 90%
|
정답 : [ 1 ] 정답률 : 87% |
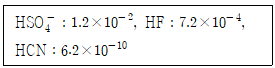
| 2과목 : 분석화학 |
정답 : [ 3 ] 정답률 : 69%
|
정답 : [ 4 ] 정답률 : 75%
|
정답 : [ 4 ] 정답률 : 81% |
정답 : [ 3 ] 정답률 : 84% |
정답 : [ 3 ] 정답률 : 84%
|
정답 : [ 3 ] 정답률 : 76%
|
정답 : [ 4 ] 정답률 : 84% |
정답 : [ 4 ] 정답률 : 58% |
정답 : [ 4 ] 정답률 : 51%
|
정답 : [ 2 ] 정답률 : 81%
|
정답 : [ 2 ] 정답률 : 89% |
정답 : [ 1 ] 정답률 : 84% |
정답 : [ 1 ] 정답률 : 76%
|
정답 : [ 4 ] 정답률 : 61% |
정답 : [ 4 ] 정답률 : 85% |
정답 : [ 3 ] 정답률 : 52%
|
정답 : [ 4 ] 정답률 : 47%
|
정답 : [ 4 ] 정답률 : 64%
|
정답 : [ 4 ] 정답률 : 66%
|
정답 : [ 2 ] 정답률 : 84%
|
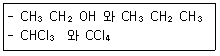
| 3과목 : 기기분석I |
정답 : [ 1 ] 정답률 : 50% |
정답 : [ 1 ] 정답률 : 67% |
정답 : [ 3 ] 정답률 : 73% |
정답 : [ 3 ] 정답률 : 74% |
정답 : [ 1 ] 정답률 : 59%
|
정답 : [ 2 ] 정답률 : 46%
|
정답 : [ 1 ] 정답률 : 58%
|
정답 : [ 4 ] 정답률 : 77%
|
정답 : [ 1 ] 정답률 : 54%
|
정답 : [ 1 ] 정답률 : 50% |
정답 : [ 4 ] 정답률 : 55%
|
정답 : [ 2 ] 정답률 : 65%
|
정답 : [ 1 ] 정답률 : 64%
|
정답 : [ 2 ] 정답률 : 80%
|
정답 : [ 2 ] 정답률 : 63%
|
정답 : [ 4 ] 정답률 : 63% |
정답 : [ 2 ] 정답률 : 43%
|
정답 : [ 3 ] 정답률 : 62%
|
정답 : [ 3 ] 정답률 : 60% |
정답 : [ 1 ] 정답률 : 66% |
정답 : [ 2 ] 정답률 : 84% |
정답 : [ 1 ] 정답률 : 74% |
정답 : [ 3 ] 정답률 : 82%
|
정답 : [ 1 ] 정답률 : 58% |
정답 : [ 3 ] 정답률 : 53%
|
정답 : [ 4 ] 정답률 : 61%
|
정답 : [ 4 ] 정답률 : 83% |
정답 : [ 1 ] 정답률 : 58% |
정답 : [ 1 ] 정답률 : 62% |
정답 : [ 1 ] 정답률 : 55%
|
정답 : [ 4 ] 정답률 : 78%
|
정답 : [ 4 ] 정답률 : 66% |
정답 : [ 4 ] 정답률 : 51%
|
정답 : [ 2 ] 정답률 : 69% |
정답 : [ 4 ] 정답률 : 72%
|
정답 : [ 2 ] 정답률 : 62% |
정답 : [ 2 ] 정답률 : 52%
|
정답 : [ 1 ] 정답률 : 66% |
정답 : [ 1 ] 정답률 : 57%
|
정답 : [ 4 ] 정답률 : 54%
|
정 답 지
| 1과목 : 일반화학 |
정답 : [ 2 ] 정답률 : 86%
|
정답 : [ 2 ] 정답률 : 84%
|
정답 : [ 4 ] 정답률 : 72%
|
정답 : [ 1 ] 정답률 : 91% |
정답 : [ 3 ] 정답률 : 64%
|
정답 : [ 2 ] 정답률 : 82%
|
정답 : [ 3 ] 정답률 : 81%
|
정답 : [ 4 ] 정답률 : 60%
|
정답 : [ 1 ] 정답률 : 87%
|
정답 : [ 2 ] 정답률 : 88% |
정답 : [ 3 ] 정답률 : 88%
|
정답 : [ 3 ] 정답률 : 86%
|
정답 : [ 4 ] 정답률 : 85%
|
정답 : [ 2 ] 정답률 : 83%
|
정답 : [ 4 ] 정답률 : 63% |
정답 : [ 3 ] 정답률 : 81%
|
정답 : [ 4 ] 정답률 : 76% |
정답 : [ 3 ] 정답률 : 89% |
정답 : [ 1 ] 정답률 : 90%
|
정답 : [ 1 ] 정답률 : 87% |
| 2과목 : 분석화학 |
정답 : [ 3 ] 정답률 : 69%
|
정답 : [ 4 ] 정답률 : 75%
|
정답 : [ 4 ] 정답률 : 81% |
정답 : [ 3 ] 정답률 : 84% |
정답 : [ 3 ] 정답률 : 84%
|
정답 : [ 3 ] 정답률 : 76%
|
정답 : [ 4 ] 정답률 : 84% |
정답 : [ 4 ] 정답률 : 58% |
정답 : [ 4 ] 정답률 : 51%
|
정답 : [ 2 ] 정답률 : 81%
|
정답 : [ 2 ] 정답률 : 89% |
정답 : [ 1 ] 정답률 : 84% |
정답 : [ 1 ] 정답률 : 76%
|
정답 : [ 4 ] 정답률 : 61% |
정답 : [ 4 ] 정답률 : 85% |
정답 : [ 3 ] 정답률 : 52%
|
정답 : [ 4 ] 정답률 : 47%
|
정답 : [ 4 ] 정답률 : 64%
|
정답 : [ 4 ] 정답률 : 66%
|
정답 : [ 2 ] 정답률 : 84%
|
| 3과목 : 기기분석I |
정답 : [ 1 ] 정답률 : 50% |
정답 : [ 1 ] 정답률 : 67% |
정답 : [ 3 ] 정답률 : 73% |
정답 : [ 3 ] 정답률 : 74% |
정답 : [ 1 ] 정답률 : 59%
|
정답 : [ 2 ] 정답률 : 46%
|
정답 : [ 1 ] 정답률 : 58%
|
정답 : [ 4 ] 정답률 : 77%
|
정답 : [ 1 ] 정답률 : 54%
|
정답 : [ 1 ] 정답률 : 50% |
정답 : [ 4 ] 정답률 : 55%
|
정답 : [ 2 ] 정답률 : 65%
|
정답 : [ 1 ] 정답률 : 64%
|
정답 : [ 2 ] 정답률 : 80%
|
정답 : [ 2 ] 정답률 : 63%
|
정답 : [ 4 ] 정답률 : 63% |
정답 : [ 2 ] 정답률 : 43%
|
정답 : [ 3 ] 정답률 : 62%
|
정답 : [ 3 ] 정답률 : 60% |
정답 : [ 1 ] 정답률 : 66% |
정답 : [ 2 ] 정답률 : 84% |
정답 : [ 1 ] 정답률 : 74% |
정답 : [ 3 ] 정답률 : 82%
|
정답 : [ 1 ] 정답률 : 58% |
정답 : [ 3 ] 정답률 : 53%
|
정답 : [ 4 ] 정답률 : 61%
|
정답 : [ 4 ] 정답률 : 83% |
정답 : [ 1 ] 정답률 : 58% |
정답 : [ 1 ] 정답률 : 62% |
정답 : [ 1 ] 정답률 : 55%
|
정답 : [ 4 ] 정답률 : 78%
|
정답 : [ 4 ] 정답률 : 66% |
정답 : [ 4 ] 정답률 : 51%
|
정답 : [ 2 ] 정답률 : 69% |
정답 : [ 4 ] 정답률 : 72%
|
정답 : [ 2 ] 정답률 : 62% |
정답 : [ 2 ] 정답률 : 52%
|
정답 : [ 1 ] 정답률 : 66% |
정답 : [ 1 ] 정답률 : 57%
|
정답 : [ 4 ] 정답률 : 54%
|
정 답 지
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
② | ② | ④ | ① | ③ | ② | ③ | ④ | ① | ② | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
③ | ③ | ④ | ② | ④ | ③ | ④ | ③ | ① | ① | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
③ | ④ | ④ | ③ | ③ | ③ | ④ | ④ | ④ | ② | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 |
② | ① | ① | ④ | ④ | ③ | ④ | ④ | ④ | ② | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 |
① | ① | ③ | ③ | ① | ② | ① | ④ | ① | ① | 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 |
④ | ② | ① | ② | ② | ④ | ② | ③ | ③ | ① | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 |
② | ① | ③ | ① | ③ | ④ | ④ | ① | ① | ① | 71 | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 |
④ | ④ | ④ | ② | ④ | ② | ② | ① | ① | ④ |
, 필기, 기출문제, 전자문제집, CBT, 온라인, 모의테스트, 모의고사